CONCEPT
Synthesis of different approaches makes something unique.

体内環境の体外再構築への挑戦
臓器は、それぞれマクロな異方構造を有し、さらに各臓器内においても領域ごとに異なる分化誘導され機能を持っています。しかし多くのオルガノイドは、空間的に単一の条件下で、位置情報を失った細胞の自律形成に依存して作られるため、外見的には球状で、その中に分化した細胞が点在するものがほとんどであり、この延長線上では、臓器本来の構造を作ることは至難です。このマクロな異方構造を体外で再構築するためには、体内環境のように細胞が位置情報を認知可能な「場」を作り上げ、細胞集団の自律形成を目的の方向に誘導する必要があると私たちは考えています。しかし、数百の因子が複合的に絡みあう体内の複雑性を、体外で完全に再構築することは不可能であるため、臓器の複雑な構造を再構築するためには、in vitroならではの場の設計・制御理論と技術を確立する必要です。そこで私たちは、培養の場を如何に設計・制御すれば目的のマクロ構造に細胞集団を自律形成させることができるのか方法論を確立し、実際に必要な場の因子を時空間的に制御して臓器の複雑形態を再構築するための技術開発を行うことを目指しています。
これまでに、立体的な細胞組織を周囲の基質ごと容易に操作可能なCUBEデバイスを開発しました。CUBEは5mm角の立方体フレームの中に細胞やゲル、成長因子を充填して使用できます。構造がシンプルで操作が容易(ピンセットで持てる)であることから、このCUBEをオルガノイドのキャリアとして用いることで、in vitro培養における場を制御するための,様々な工学技術を詰め込むことが可能となり、これまでに①細胞集団の三次元形状制御,②表面張力を利用した異種ECMの局在制御,③流体チップ内との統合による因子濃度勾配形成制御,④組織間相互作用解析が可能なOrgan-on-Chipの構築、をそれぞれ達成してきました。
本CUBEデバイスは単体の構造がシンプルが故に、培養場の時空間を定量的に操作することが可能であり、 再現性の高いin vitroの実験を行うことができることから、オルガノイドの実験プラットフォームとして最適だと考えています。さらに空間的に分割した“モジュール”を形成することが可能であり、それぞれのモジュール内で独立した要素を含んで組み合わせたシステムを作り上げることができるため、複雑なシステムを単純な要素の組合せに落とし込むことができというのが大きなメリットとなります。
現在これら技術を生かして、以下のような様々な場の作り込みによる1)オルガノイド形態制御、2)組織間相互作用モデルの構築、に取り組んでいます。
細胞・ECM・液性因子の空間制御による、オルガノイド形態制御

体軸形成プラットフォームによる神経管形成プロセスの再構築
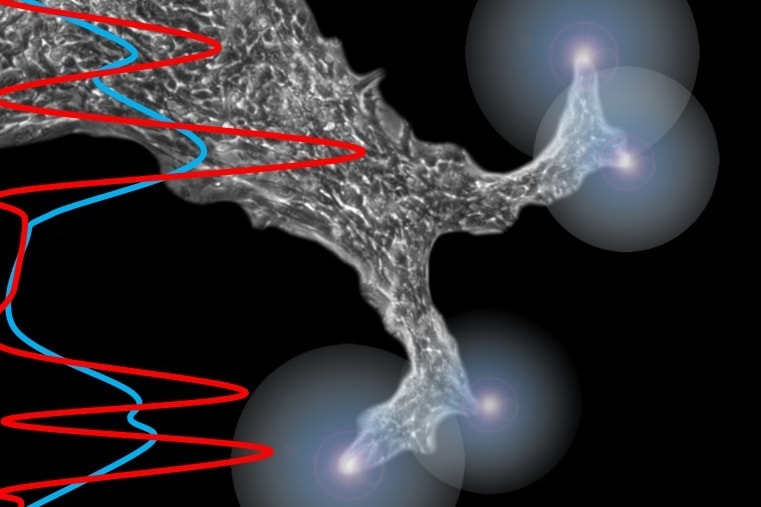
生物の発生過程において、その初期段階から背腹・尾頭・左右となる体軸情報が細胞に対して与えられることで、空間情報に応じた分化・機能が定まり非対称な臓器形成が達成される。特に神経管形成に関しては細胞がメカノケミカルなフィードバックを受けて、背腹軸・尾頭軸にかけて詳細な分化パターンが精密に形成され、その後の発生過程において大きな役割を果たす。この体軸形成を含むミニ臓器を体外で再構築するためには、現状の体内とかけ離れた環境下での細胞任せの形づくりから、より体内に近い培養環境を細胞に与え、時空間的に正しい情報を細胞に届けることが必要不可欠である。そこでモジュール化したデバイスを用いて、体軸形成における時空間情報を、周囲環境を制御することで適切に細胞に与え、神経管閉鎖から分化パターン誘導形成過程を体外で再構築することを目指している。


バリア機能組織の再構築による薬物動態モデルへの応用
人の体には、外部の物質が簡単に体内に侵入しないように守るためのバリア機能を持った組織が数多く存在しています。血液脳関門(Blood-Brain-Barrier: BBB)もその一つであり、脳周囲の血管は脳を守るために他の血管よりも強固に作られています。しかし、このBBBのバリア機能があるが故に、脳に薬が届かないという問題も生じています。私たちは、この血液脳関門のバリア機能を、ヒトiPS細胞から分化誘導した脳血管内皮細胞と、内皮細胞をサポートしているアストロサイト・ペリサイトの初代細胞をCUBE内で共培養することにより、タイトジャンクション・トランスポーターといったBBBの一部機能を再現することに成功しました。
同様に、皮膚を構成するヒト由来のケラチノサイトと繊維芽細胞をCUBE内で共培養し、角質化させることにより、バリア機能をもった皮膚モデルも構築しています。
これらバリア機能を有した組織モジュールを用いることで、薬の候補化合物がどの程度バリアを通過することができるのか、薬物動態の試験に応用することができるようになります。さらにモジュール化された組織は、容易に流体チップ内への統合が可能となるため、他のモジュール化されたオルガノイドと組み合わせることで、組織間相互作用を解析するためのモデルへと展開することができ、現在様々な相互作用モデルの構築を進めています。
細胞から組織パターンへの自律形成メカニズム解析
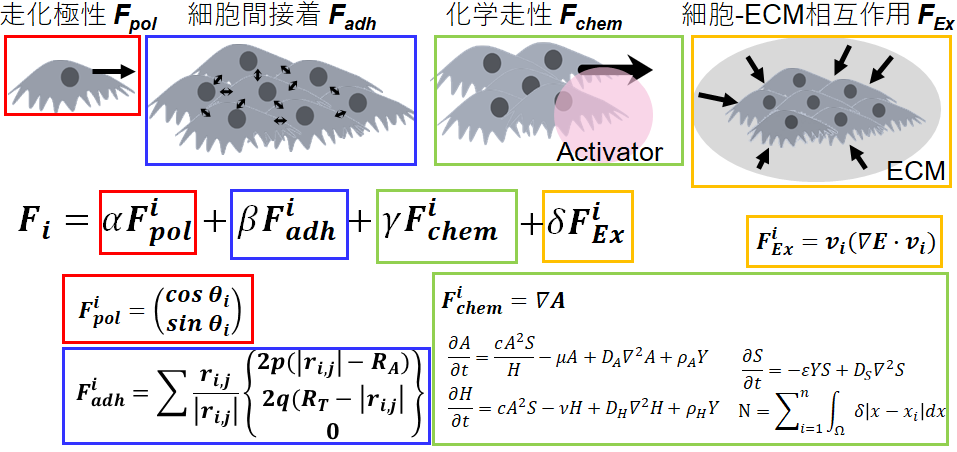
細胞が何かしらのルールに従って行動していることは明らかであっても,ディッシュに一様に培養されていると、細胞サイズでのちょっとした違いに引っ張られて細胞の状態変化は発生するため、そのルールに気づかないことが多い。さらに培養環境のバラつきは細胞集団の成長過程で加速的に大きくなり,結果の再現性を大きく劣化させる要因にもなる.一方,培養環境を制御することにより,このバラつきを抑え環境に摂動を与えることで細胞が持つルールをあぶりだすことも可能です。例えば気管支上皮細胞の集団をディッシュ上で特定の条件下で三角形に配置すると,必ず細胞は三角形の頂点方向に動き始め,円形に配置すると全体が回転しますというユニークな動き方をするようになります.このことは集団の境界条件によって細胞の移動方向が変化しています.では境界条件の変化によって何が変わって細胞行動に影響を与えるのか.突き詰めていくことで細胞のルールをより詳細に理解することができると考えています.